La tradición incaica indica que fueron Manco Cápac y Mama Ocilo, los fundadores del Imperio Incaico, quienes introdujeron "la planta de las plantas", aunque también se piensa que pudo ser traída desde Colombia por indígenas desplazados.
Zárate, médico español que actuó en América, escribió en 1555: "En determinados valles crece la planta llamada coca, que los indios aprecian más que el oro y la plata; el misterio de esta planta consiste en que quien lleva siempre algunas hojas en la boca no siente jamás frío, ni hambre, ni sed."
El coquero hace con las hojas, en la boca, un bolo (acullico, piccho o chaccha), que alcaliniza con cal viva para favorecer la disolución del principio activo. Lo mastica (cocar o acullicar) mientras está jugoso, aproximadamente durante tres horas. A veces calculan en "cocadas" las distancias que deben recorrer.
En el siglo XVl, el II Concilio de Lima prohibió su consumo so pena de excomunión, pero siguió siendo utilizada por los naturales. En 1569 un Real Decreto (la famosa y diabólica inquisición) estableció que la masticación de coca era "idolatría y obra del diablo" (una verdadera incongruencia histórica).
Relata José D'Acosta, en 1590, en su Historia natural y moral de las Indias: "Usaban la coca como cosa regia y apetitosa; era lo que más ofrecían en sus sacrificios, quemándola en honra de sus ídolos."
El historiador William Prescott, en 1843, escribía: "Con una pequeña provisión de coca en el bolsillo y un puñado de maíz asado, el indio peruano hace día tras día sin fatiga sus cansados viajes, o al menos sin quejarse. La nutrición misma, aun la más fortificante, le es menos agradable que su narcótico favorito."
En 1846, el explorador y naturalista suizo J. J. Tschudi dio una detallada descripción del consumo: "Todos los indios llevan enganchado a la cintura un saco de cuero, al que llaman huallqui o chuspa, en el que, además de una provisión de hojas, guardan una calabaza, a menudo finamente esculpida (ischujuru), que contiene cal viva pulverizada.
Tres veces al día como mínimo, cuatro en la mayoría de los casos, los indígenas dejan de trabajar y se dedican a masticar coca (cocar o acullicar). Sacan las hojas del huallqui cuidadosamente, una por una, quitan los nervios y cortan la hoja en varios trozos que se introducen sucesivamente en la boca, mascándolos hasta formar detrás de los molares un bolo bastante voluminoso (accullico); luego toman un tallo delgado y humedecido en cal viva y lo llevan a la pastilla que tienen en la boca, a la que se adhiere el polvo que trasporta. Repiten la acción hasta que obtienen el punto deseado. La saliva, cuya secreción se hace muy abundante, se mezcla con el jugo verde de las hojas; solo se escupe en parte, tragándose la mayoría."
Con referencia a los coqueros dice: "Se los conoce por su andar incierto y vacilante, su carne fofa, de un gris amarillo; sus ojos hundidos y sin brillo; sus profundas ojeras azuladas; sus labios trémulos; sus discursos incoherentes, su indolencia y su apatía. Apenas llegados a la plenitud de la edad, ya tienen aspecto de ancianos, y, si llegan a la vejez, la imbecilidad es la consecuencia de su pasión desenfrenada."
El químico Mariani importó hojas de coca y elaboró vino, elixir, pastillas, té y tabletas a los que dio su nombre y que lograron fama y popularidad en toda Europa.
Después de obtenido su principio activo, la cocaína, comenzó la difusión de la toxicomanía. El médico W. H. Bentley expresó en 1880: "Yo sé por qué algunos médicos dicen que la cocaína no produce hábito. Es que no basta ni con una ni con dos dosis. Hay que continuar hasta que la droga empieza a gustar, hasta que se espera con ansia el momento de tomaría, hasta que no se puede esperar la llegada de ese momento. Y cuando llega ese instante, la cocaína domina con más fuerza que la morfina. He venido a decirles lo que es ese hábito. Y ante Dios, señores, yo les digo que lo sé. Lo sé porque soy cocainómano y no puedo dominarme."
En 1889, Valentín Magnan, psiquiatra francés, publica sus Observaciones sobre las alucinaciones táctiles, características de la cocainomanía y conocidas desde entonces como signo de Magnan. Los drogados tienen la sensación de que pequeños animales, a veces de colores, les recorren la piel. Los trastornos sensoriales pueden alcanzar tal magnitud que algunos pacientes llegan a herirse, en su afán de dar caza a los animales imaginarios.
En Francia, la cocainomanía hizo estragos a partir de 1912. Se la ha considerado el vicio femenino por excelencia, denominándosela "coco". Las encargadas de los guardarropas de cabarés y clubes nocturnos ofrecían a la clientela hermosas bolsitas conteniendo cocaína con los atrayentes nombres de "coco universal" o de "ídolo universal". Según G. Gulíain, en 1912, la mitad de las prostitutas de Montmartre eran cocainómanas y el vicio se extendía a los homosexuales.
Los propios laboratorios promocionaban la droga enviando cartas a la población: "Si se siente abatido y pesimista no pierda tiempo, sea feliz. Escriba y a vuelta de correo le mandaremos un alcaloide que le evitará los sufrimientos."
En 1924 existían en París 80.000 cocainómanos, según la estimación policial. Los five o'clock coco eran tan "in" como los actuales LSD parties en opinión de Varenne.
ESTRUCTURA QUÍMICA
El núcleo tropánico es un heterociclo nitrogenado bicíclico: El 8-aza biciclo (3,2,1) octano. El número de alcaloides derivados de este esqueleto, es bastante escaso y su distribución muy reducida: Solanaceas, Eritroxiláceas y esporádicamente en algunas Convolvuláceas, Proteáceos, Euforbiáceas y Rizoforáceas.



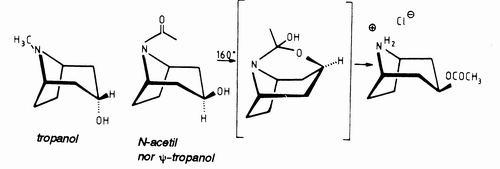
En estas moléculas, el grupo N-metílico se encuentra en posición ecuatorial y el ciclo piperidínico, adopta una configuración en «silla». La configuración en 3 del tropanol y del pseudotropanol, se deduce del examen del comportamiento de algunos de sus derivados, y ha sido confirmada, por la diferencia de velocidad de hidrólisis de sus benzoatos. Así, el clorhidrato de N-acetil norpseudotropanol, se reagrupa, vía una oxacina, en un dérivado O-acetilado y este reagrupamiento no es posible en el caso del tropanol (Fig.Nº4). Estos alcoholes son ópticamente inactivos: son formas meso y los dos carbonos de unión son de quiralidad opuesta.
Los ácidos orgánicos que esterifican estos alcoholes (Fig.Nº 5), ya sean ácidos alifáticos de pequeño peso molecular como el ácido 3-metil butírico (Fig.Nº 5), o el ácido (2E) 2-metil butenoico (= ácido tíglico) o bien sean ácidos aromáticos de C6 –C1 como el ácido benzoico o, de C6-C3 como el ácido cinámico, o el ácido (R) α-hidroxi β-fenilpropiσnico (Fig.Nº 5), o incluso el ácido (S)-(-)-trópico.



En el caso de la escopolamina también llamada hioscina por autores anglosajones), la hidrólisis ácida o alcalina conduce al ácido (-)-trópico o o al ácido (±)-trópico y a la oscina compuesto ópticamente inactivo, que se desdobla al estado de benzoatos. En las condiciones suaves de una hidrólisis enzimática, se produce escopanol (o escopina) (Fig.Nº 8), que por vía química se transforma fácilmente en oscina.
Por lo que respecta a la cocaína, se hidroliza en ecgonina, metanol y ácido benzoico: y si la hidrólisis es controlada, puede formarse benzoilecgonina.
Los alcaloides ópticamente activos como la hiosciamina, se racemizan con facilidad, siendo suficiente un tratamiento a reflujo con cloroformo para transformarla en atropina. Sobre la atropina, aunque haya sido descrita a menudo y en varios vegetales, es necesario preguntarse si en todos los casos conocidos, se trata realmente de un producto natural.

Los alcaloides tropánicos se forman a partir de varios precursores:
De la fenilalanina, en el caso de los ácidos aromáticos de C6-C1 o de C6-C3 y de aminoácidos como la leucina o la isoleucina, en el caso de los ácidos de C5.
De la ornitina, en el caso del heterociclo tropánico, siendo los carbonos complementarios aportados por el acetato (carbonos 2, 3 y 4) o por la S-adenosil metionina (el N-metilo).
Origen del núcleo tropánico
La metilación del nitrógeno de la ornitina se origina en una etapa inicial, y como ya se ha mencionado, la incorporación del aminoácido no es simétrica. La etapa clave de la biosíntesis es finalmente el ataque nucleófilo del anión acetoacetato sobre el ion pirrol idinium.

Se ha demostrado por marcaje, que el precursor de este ácido es la fenilalanina. Marcando doblemente con 13C los carbonos 1 y 3, y registrando a la vez los espectros de RMN de '3C del ácido trópico obtenido, se ha demostrado que el reagrupamiento es intramolecular, lo que podría implicar un intermediario con ciclo oxiránico.

Los alcaloides ésteres del ácido trópico, se caracterizan fácilmente por la reacción de Vitali-Morin: después de tratar con ácido nítrico fumante y tomar el residuo con acetona, se desarrolla una coloración violeta oscuro, en presencia de potasa alcohólica.
Los alcaloides pueden también detectarse por CCD (cromatografía en capa delgada), pero este método no distingue los isómeros ópticamente activos de los racémicos. Se pueden obtener buenas separaciones por CG y por CLAR en fase reversa.
Se pueden realizar diversos tipos de valoración: acidimétrica, protométrica en medio no acuoso y colorimétrica, realizando previamente una nitración y una reducción (ZnIClH) el producto es diazotado y acoplado a la etilenodiamina.




CARACTERÍSTICAS DEL CLORHIDRATO DE COCAÍNA
Chlorhydratum cocaine C17H2104N,Cl H
Peso Molecular.: 339,82
El clorhidrato de cocaína contiene no menos de 99 por ciento de C17H2104N,C1H, calculado para la sustancia desecada.
Caracteres generales. - Cristales incoloros, o polvo cristalino, blanco; inodoro o con suave olor benzoico; con sabor amargo y produciendo insensibilidad pasajera de la lengua.
Soluble en menos de su peso de agua destilada, fácilmente soluble en alcohol; soluble en cloroformo y en glicerina; insoluble en éter y en aceites vegetales.
Ensayos de indentificación. - Agréguense a 1 mililitro de la solución de clorhidrato de cocaína al 1 por ciento, P/V, una o dos gotas de una solución al 3 por ciento, P/V, de bicromato de potasio: se formará un precípitado de color amarillo, que se disuelve agitando la mezcla, pero precipita nuevamente por adición de algunas gotas de ácido clorhídrico, formando un precipitado cristalino permanente de color anaranjado.
Agréguese a 0,1 gramo de clorhidrato de cocaína, 1 mililitro de ácido sulfúrico; llévese a un B.M. durante algunos minutos, y añádanse con sumo cuidado, 2 mililitros de agua destilada: deberá percibirse el olor aromático de benzoato de metilo y luego, por enfriamiento del líquido, se formarán pequeños cristales de ácido benzoico.
Disuélvase 0,05 gramo de clorhidrato de cocaína en 1,5 mililitros de agua destilada: agréguense 8,5 mililitros de solución de sulfato de aluminio y de potasio (R) y 5 mililitros de solución de permanganato de potasio (R), y agítese rápidamente durante algunos segundos: deberán formarse cristales rectangulares de color violado, característicos.
Añádanse a 2 mililitros de una solución al 5 por ciento, P/V, de clorhidrato de cocaína, 0.5 mililitro de amoníaco diluido (R) y extráigase el alcaloide con 10 mililitros de éter: sepárese este último: deshidrátese por agregado de sulfato de sodio anhidro y fíltrese.
Evapórese el liquido etéreo y séquese el residuo. cristalino en un desecador: el residuo obtenido, deberá fundir a unos 97º.
La absorción de la luz, en la región del espectro comprendida entre 230 y 350 milimicrones, de una solución al 0,001 por ciento, P/V, de clorhidrato de cocaína, en Solución 0,1 N de ácido clorhídrico, en celda de 2 centímetros de espesor presenta únicamente un máximo bien definido a unos 233 milimicrones, y una extinción E, alrededor de 0,78 a la misma longitud de onda.
La solución de clorhidrato de cocaína, deberá responder a los ensayos para los cloruros.
Ensayos de pureza. - Disuélvase 0,5 gramo de clorhidrato de cocaína, en 10 mililitros de agua destilada recientemente hervida y enfriada, y agréguese una gota de solución de rojo de metilo (R), como indicador: no deberá gastarse más de 0,5 mililitro de solución 0,02 N de hidróxido de sodio para su neutralización (acidez).
Punto de fusión: no menor de 197º, previo calentamiento del baño a 193º.
El poder rotatorio específico, a 25º, de una solución al 2 por ciento, P/V, de clorhidrato de cocaína previamente desecado, no deberá ser menor de –71º ni mayor de –73º.
Disuélvase 0,5 gramo de clorhidrato de cocaína, en 5 mililitros de ácido sulfúrico: el color de la solución no deberá ser más intenso que el del Líquido de Comparación F (sustancias fácilmente carbonizables).
En un tubo de ensayo, lavado previamente con mezcla sulfo-crómica (R) y enjuagado después con agua destilada, mézclense 5 mililitros de una solución de clorhidrato de cocaína al 2 por ciento, P/V, con cinco gotas de solución N de ácido sulfúrico y 0,1 mililitro de solución 0,1 N de permanganato de potasio: deberá obtenerse una solución límpida de color violado, que no deberá decolorarse completamente en el intervalo de treinta minutos, cuando se la mantiene a una temperatura no mayor de 200, al abrigo del polvo y de la luz (sustancias reductoras y cinamilcocaína).
Disuélvase 0,1 gramo de clorhidrato de cocaína en 100 mililitros de agua destilada; agréguese 0,2 mililitro de amoníaco y agítese fuertemente durante cinco minutos, frotando, de cuando en cuando, las paredes del recipiente con una varilla de vidrio: se producirá un enturbiamiento y después de quince minutos, un precipitado cristalino de cocaína, permaneciendo límpido el líquido sobrenadante (iso-atropilcocaína).
Por desecación en presencia de gel de sílice durante tres horas, no deberá perder más de 1 por ciento de su peso.
Por incineración no deberá dejar más de 0,1 por ciento de residuo.
Valoración. - Pésese exactamente alrededor de 0,5 gramo de clorhidrato de cocaína previamente desecado, y disuélvase en una mezcla de 40 mililitros de ácido acético y 10 mililitros de solución acética de acetato de mercurio (R). Agréguense dos gotas de rojo de quinaldina (R), como indicador, y valórese con solución 0,1 N de ácido perclórico. Efectúese un ensayo en blanco con todos los reactivos, usados en las mismas condiciones y corríjase la valoración anterior.
Cada mililitro de solución 0,1 N de ácido perclórico equivale a 0,03398 gramo de C17H2104N,CIH.
Conservación. - En recipientes de cierre perfecto. (Farmacopea Argentina VI Ed. Pag.263-264)
ACCIÓN BIOQUÍMICA
Farmacocinética
La cocaína es una base débil con un pKa de 8.6. En su forma básica, tanto en sangre como en el humo del tabaco que llega a los pulmones, la cocaína atraviesa las membranas celulares de forma rápida y eficazmente. Atraviesa la barrera hematoencefálica: esnifada o administrada por vía intravenosa se encuentran niveles de cocaína en el cerebro en 30 segundos, mientras que fumada sólo tarda 5 segundos en tener efectos centrales.
Absorción: La cantidad relativa de cocaína que se absorbe a nivel sistémico depende fundamentalmente de la vía de administración.
La absorción por la mucosa nasal después de esnifar y la absorción a través del tracto digestivo después de su administración oral es similar y mucho más lenta que después de fumar o después de la administración intravenosa.
El pico plasmático se produce normalmente a los 60 minutos después de la administración nasal u oral; aunque como en otros parámetros de la cinética de la cocaína, la variabilidad individual es muy grande, con intervalos de 30 a 120 minutos. La biodisponibilidad nasal u oral es de un 30-40%, aunque la variabilidad es mayor para la vía oral.
Al igual que ocurre con la nicotina del tabaco, la biodisponibilidad de la cocaína fumada varía entre un 10 a 20%, siendo el porcentaje menor la más común. Cuando hacemos determinaciones urinarias de metabolitos de cocaína como seguimiento de tratamientos, debemos tener en cuenta que la cocaína fumada presenta una biodisponibilidad baja y variable.
Las concentraciones máximas venosas y arteriales después de las diferentes administraciones varía enormemente. No sólo depende de las dosis y de las vías de administración sino también de la frecuencia de las inyecciones. El rango de las dosis de cocaína normalmente varían entre 0.2 a 3 o 4 mg/Kg, dependiendo de la vía de administración, sin embargo las concentraciones plasmáticas máximas varían en un rango entre 50 a 2000 ng/ml o mayor dependiendo de la vía de administración y de la frecuencia de las inyecciones.
Distribución: La cocaína después de ser administrada, es distribuida ampliamente por todo el organismo. El volumen de distribución varía entre 1.5 a 2 L/Kg (57% por vía oral y aproximadamente 70% fumada).
Metabolismo: La cocaína es rápidamente metabolizada, generalmente por hidrólisis enzimática para producir benzoilecgonina (BE), ecgonina metil ester y posteriormente ecgonina. En un 1-5% se excreta por la orina sin cambios.
La hidrólisis a benzoilecgonina se produce en un 45% de una dosis administrada; porcentaje similar a la hidrólisis a ecgonina metil ester. Ninguno de los dos metabolitos poseen actividad biológica significativa en humanos. La norcocaína nitróxido y otros radicales libres son metabolitos potencialmente activos, pero se producen en pequeñas cantidades que generalmente no representan cantidades farmacológicamente significativas en clínica humana.
Cuando la cocaína se fuma, la droga se piroliza a una serie de compuestos químicos dependiendo de la temperatura. El principal metabolito es la anhidroecgonina metil ester (AEME), también conocida como metil ecgonidina.
AEME es farmacológicamente activo en animales, sin embargo en humanos existen muy pocos trabajos y no se conoce con exactitud su perfil farmacológico (podría tener efectos inotrópicos negativos). AEME se puede determinar en orina, incluso después de que se hayan fumado pequeñas cantidades; sin embargo este metabolito no aparece cuando la cocaína se esnifa o se administra por vía intravenosa. Por tanto, su interés radica fundamentalmente en el control urinario de consumo de cocaina fumada en pacientes en tratamientos de desintoxicación.
La benzoilecgonina es el metabolito que se detecta en orina, más utilizado para monitorizar los tratamientos. Puede ser detectada en orina 3-4 días después del último consumo y por supuesto dependerá de la cantidad de cocaína consumida y del valor de corte que se establezca o de la sensibilidad de la prueba.
La vía de administración también influye en la cantidad de BE que se detecta en plasma y que se eliminará a través de la orina. En general, se puede decir que las máximas concentraciones y la mayor área bajo la curva se produce después de administraciones nasales u orales. Cuando la cocaína se fuma, aunque los efectos que se producen son mucho más intensos y precoces, la cantidad absorbida es menor y por tanto las concentraciones de BE en plasma son también menores.
Eliminación: El aclaramiento de la cocaína es muy rápido, variando entre 20 a 30 ml/min/Kg. La semivida plasmática es, de nuevo, variable con intervalos de 1 a 1.5 horas. La benzoilecgonina presenta una semivida plasmática de 6-8 horas y la ecgonina metil ester de 3-8 horas.
Mecanismo de Acción
La cocaína se comporta como una amina simpaticomimética de acción indirecta, es decir, es capaz de remedar las acciones de las catecolaminas no actuando directamente sobre los receptores adrenérgicos o dopaminérgicos, sino aumentando la disponibilidad del neurotransmisor en la hendidura sináptica.
La cocaína es un inhibidor de los procesos de recaptación tipo I (recaptación de noradrenalina y dopamina desde el intersticio sináptico la terminal presináptica; lo que facilita la acumulación de noradrenalina o dopamina en la hendidura sináptica.

A continuación, este neurotransmisor difunde a través de la hendidura sináptica y se une a su receptor, desencadenando un cambio conformacional en el receptor que permite la entrada de cationes en la célula postsináptica. Este flujo iónico conduce a la variación de las propiedades eléctricas de la membrana postsináptica.
(Dibujado por Lisa Shoemaker. Rawn) (Fig. Nº 12).
El aumento de la biodisponibilidad de dopamina por la inhibición de la recaptación tipo I media la euforia que produce la cocaína y parece que está implicada en el mecanismo de adicción. El consumo crónico de cocaína también produce cambios en la disponibilidad de la dopamina.
En los estos últimos años se ha implicado al transportador de la recaptación de dopamina no sólo en las acciones conductuales sino también en las acciones bioquímicas de la cocaína. El transportador de la recaptación de dopamina controla los niveles de este neurotransmisor a nivel del intersticio sináptica ya que incorpora rápidamente a la terminal presináptica la dopamina liberada.
En ratones genéticamente deficientes estudiados en laboratorio, en este transportador, la administración de cocaína no produce efectos conductuales ni bioquímicos. Por tanto, parece que dicho transportador es necesario para la acción farmacológica de la cocaína ya que al bloquearlo, uniéndose de manera específica y con gran afinidad, inhibiría la recaptación dopaminérgica.
La noradrenalina en exceso que se produce por acción de la cocaína, es el responsable de la mayoría de los efectos farmacológicos y de las complicaciones agudas de la cocaína (aumento de presión arterial, dilatación pupilar, sudoración, temblor ). Esta acción simpaticomimética se manifiesta en la vasoconstricción, hipertensión, estimulación cardíaca (peligrosa), excitación simpática seguida de depresión y crisis epileptoides
La cocaína también bloquea la reabsorción de noradrenalina y de serotonina en la sinapsis, por lo que posee una acción adrenérgica, actuando sobre los centros hipotalámicos que excitan el SN simpático y el consumo crónico de esta sustancia produce cambios en estos neurotransmisores con una disminución de la biodisponibilidad que se refleja en la disminución de los metabolitos 3-metoxi-4-hidroxifenetilenglicol (MHPG) y ácido 5-hidroxiindolacético (5-HIAA). Estos efectos sobre la neurotransmisión catecolaminérgica y serotoninérgica constituyen, asímismo, la base de su mecanismo de acción como droga dependiente.
Pasando a otra efecto, es conocido que la cocaína fue el primer anestésico local utilizado en clínica.
Desde entonces, se han sintetizado un número importante de estos agentes, el primero de los cuales fue la procaína (novocaína) en 1905. La cocaína comparte con todos estos compuestos el mecanismo de acción anestésica local, estabiliza la membrana de la fibra nerviosa, taponando los canales específicos de Na, lo que bloquea la permeabilidad de aquellos iones, lo que produce un bloqueo de la conducción nerviosa.
Las soluciones de cocaína utilizadas en clínica, únicamente para anestesia tópica, varían del 1 al 10 %. Aunque ha sido sustituida por fármacos más manejables y con menos efectos secundarios, se utilizó en anestesia oftálmica y en anestesia tópica de la mucosa nasal previa a la intubación nasotraqueal.
No hay comentarios:
Publicar un comentario